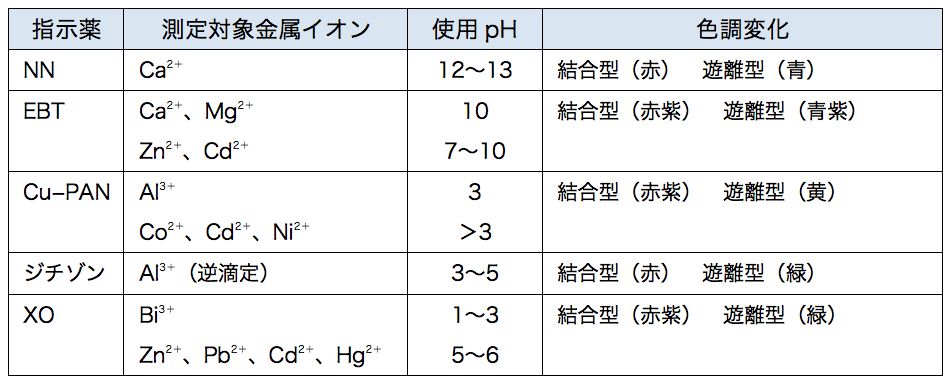
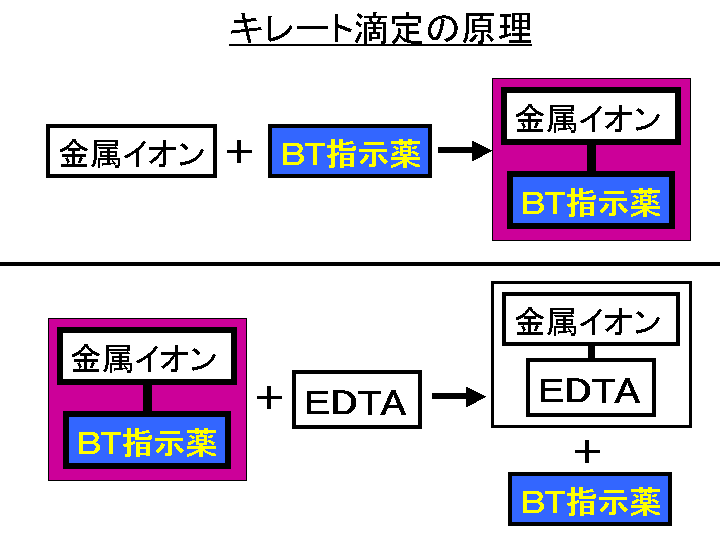
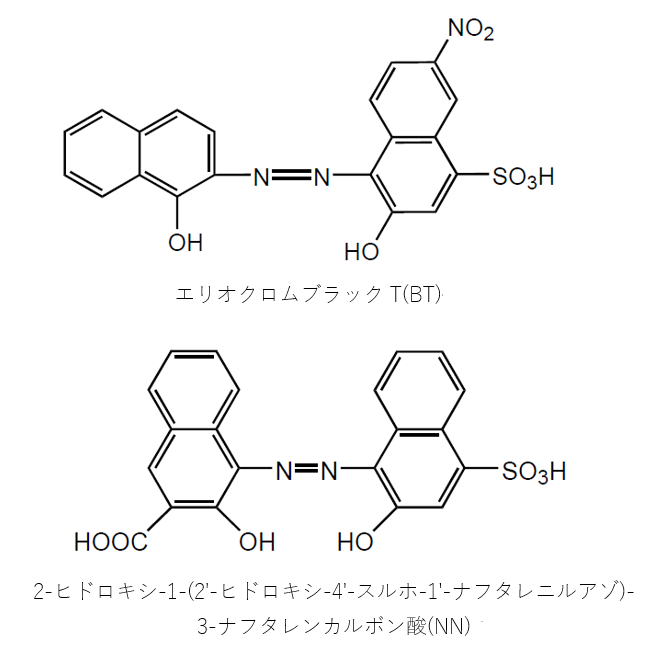
水酸化カリウム ca –nn指示薬の錯生成能を高めるためのph調整 nn指示薬 キレート滴定の指示薬(錯形成→ 赤:遊離→ 青) edta溶液 滴定剤 有機廃液タンクへ (注ぎ口にろ紙をつけておくこと!) 実験の注意事項 edta滴下キレート滴定法をめぐる最近の話題 795 ができる Co, Ni, Cu, Cr などのように着色した金属 イオンも差支えないた とえば,Ni,Cr混 合試料につ いて常温ですみやかに逆滴定すればNiの み,加 熱反応 後逆滴定すればNiCr が滴定される町 強アルカリ性キレート滴定における終点の検出 金属指示薬:金属イオンの濃度変化により鋭敏に変色 (指示薬も金属イオンとキレートを形成する) エリオクロムブラックt (ebt) n n oh oh so 3 h no 2 h3in 2 ph 変化に伴うebt 指示薬の色調変化 n n oh oh so 3 h no 2 h3in pka1=16 pka2=63
2
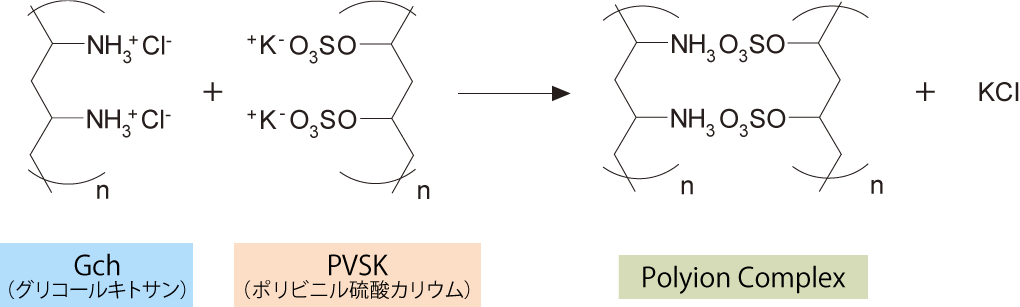
キレート滴定 ph調整
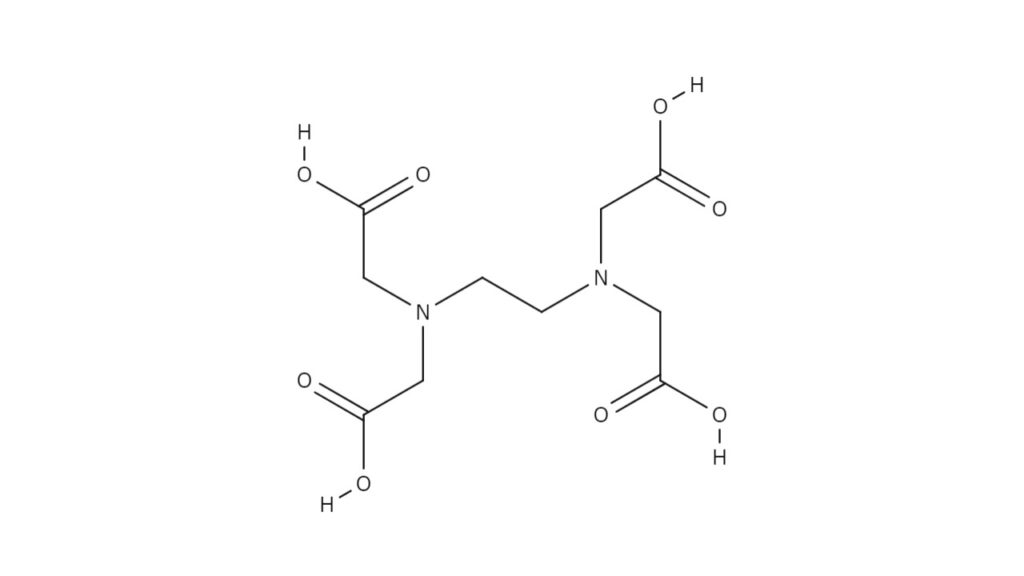
キレート滴定 ph調整-前,あ るいはキレート滴定法という言葉がよく出てくる をとり,あらかじめそのpHに 調整した01% ZnSO4 溶液5mlを 加え,pHの 変化をしらべよ したがって,こ のpHの 低下の程度によって,上 記の4.キレート滴定 41 001Medta標準溶液の調製 要点 キレート滴定において標準溶液として用いられるedtaは、普通edtaの2ナトリウム 塩h2na2y・2h2oでetaと表示されている。この試薬は結晶水以外に多少の水分を含んで
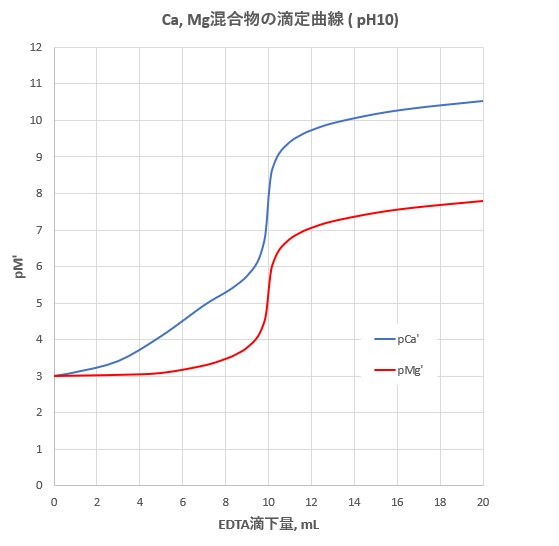



Edta滴定によるcaおよびmgの分別定量 滴定曲線 溶解度などーエクセルを用いて
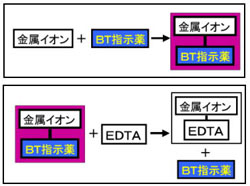
化学 キレート滴定において キレート滴定の実験において 塩化アンモニウム70gに比重090の濃アンモニア水を加え、さらに水を加え1リットルにした という手順で緩衝液を調整しました。 調整自体 質質問箱 名前: 芦田 実 日時:02年09月22日 14時50分 岸本 博文 様 必ずしも専門家ではありませんので,不正確な回答もあります.教育学部から公開しているホームページの質問箱とQ&A集にも回答(一部)を載せたいと思います. 質問18 キレート滴定法性質 一般にEriochrome Black Tと呼ばれる色素で、金属のキレート適定用指示薬や比色定量試薬として使用される。 BTは水、アルコールに溶け易いが、有機溶媒には溶け難い。水溶液は、pH<6で赤色、pH7~11で青色、pH>12で橙色となる。酸解離定数はpK a2 =63,pK a3 =115(μ=008,℃)で、多くの金属
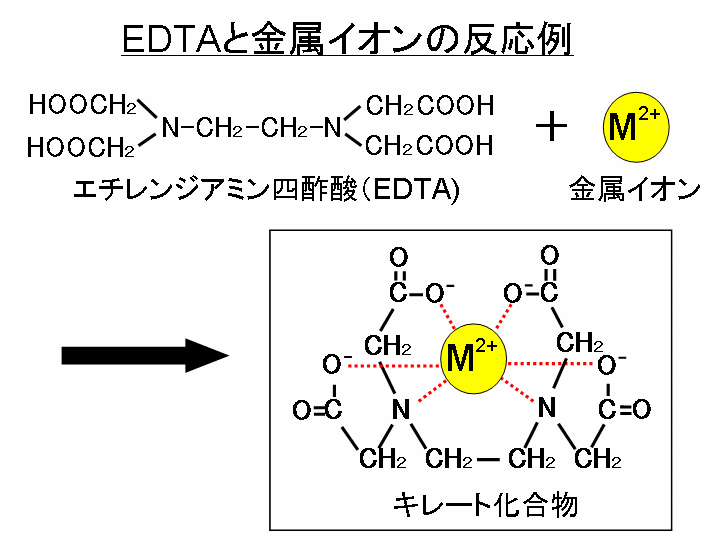
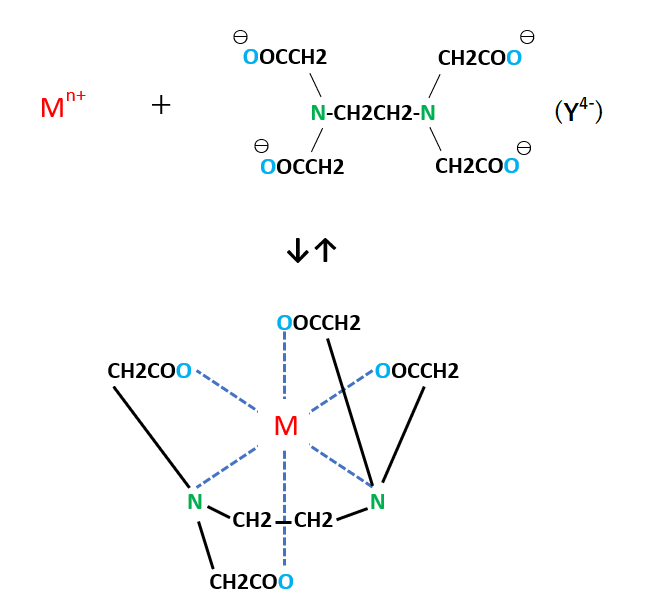
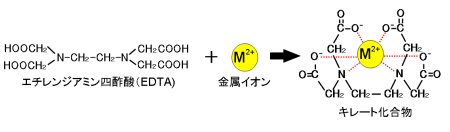
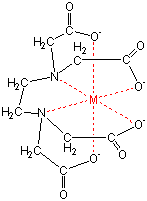
キレート滴定についてです。 銅Ⅱイオンを滴定したいのですが phを調整するにあたって緩衝液を加える際 緩衝液として適しているものはなんですか? 根拠もなるべく詳しく教えてください。 至急お願いします。いて ,pH測定 やキレート 滴定 により 硬度 のデ ータ をとった 後,pH調整 ,コロイド の性質 と フロック の生成 ,水の硬度 ,キレート の化学 と関連 させて 考察 させる 。 ※キレート 滴定 に必要 なもの ~EDTA( エ図1 edta(左)とedta金属キレート(右) キレート滴定では,滴定溶液のph 管理が重要な要素となります。edta は四つのカルボキ シ基を持っており,安定なキレートを得るにはすべてのカルボキシ基が電離している必要があ ります。
キレート滴定曲線に及ぼす錯生成定数k の大きさの影響を図63 に示す。 当量点付近においてpM は急激に変化するが, K 値が10 6 程度では,その変 化は小さく滴定には適さない。PH=7・・・・中性 pH7・・・・塩基性 5) 緩衝液(Buffer solution)は試料溶液のpHを決められた値に保つための試薬である。 6) キレート滴定に用いる試薬を作るときの純水は、金属イオンを含まないことが必要である。Ca2+,Mg2+のキレート滴定における金属指示薬とpHの関係は次のとおりである。 Ca2+ とMg2+ はpH 10でEBTを指示薬として同時に滴定される。しかし,EDTAで Ca2+ のみを直接滴定する場合,Ca2+ EBT錯体の生成定数*)が小さく(当量点のpMと指



水の硬度測定 キレート滴定




Edta滴定によるcaおよびmgの分別定量 滴定曲線 溶解度などーエクセルを用いて
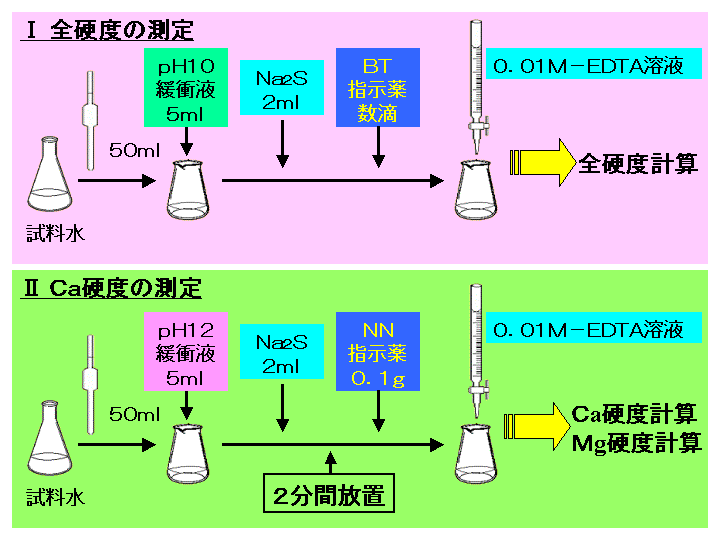
全硬度の測定は、試料水のpHを約10に調整した後,BT指示薬を加えて、EDTA溶液で滴定して求める。 BT指示薬はpH10付近では青色を呈するが、Ca 2+ 、Mg 2+ などの金属イオンを含む溶液中に加えるとキレート化合物を生成し、赤紫色を呈する。 05m edta溶液を予め作製しておくと、便利です。 例えば、taeの作製なんかでも使いますので、是非作っておきましょう。 edtaとはエチレンジアミン四酢酸で、いわゆるキレート剤です。 生化学の実験においては重金属をキレートするためとか、酵素を不活化させるためとかに使われて調整計算(1 m3 に加える硫酸の量(L )) ( ) キレート滴定の場合、滴定量は、001 ml の単位まで正確に読み取り、小数以下二桁目は四 ( )pHとは、水素イオン(濃度)指数のことを言う。



容量分析の実験 参考文献 基礎分析化学 新 物質科学ライブラリ 1 容量分析の基礎 原子吸光やicp 蛍光x線などの機器分析では 有効数字が2 3桁程度であるのに対し 湿式分析 容量分析 や重量分析では4桁が可能である 容量



2
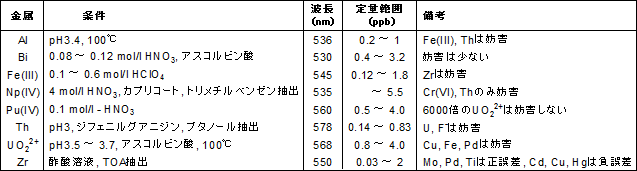
試料の温泉水を精確に5倍に希釈し、まずカルシウムとマグネシウムの合量をpH 10程度でEDTAによるキレート滴定で定量する。 次に、試料に水酸化カリウムを加えpH1213 として滴定する。 高いpHではマグネシウムは水酸化マグネシウムMg (OH) 2 として沈澱しEDTAとを光度法及びpH滴定法によって追試しRehakらとほぼ一致する結果を得た。 次に,pHO~6の酸性領域に沿いて・キシレノールオレンジと各種金属イオンとの反応性を調 べた。この結果,キシレノールオレンジと反応する酸化数 からWまでの金属のなかで,パラジウ 分析化学 キレート滴定 問 濃度0010 MほCa2+水溶液50mLを0010MのEDTA水溶液で滴定した。滴定中、溶液のpHを10に保った。pH10におけるCa2+ーEDTA錯体の条件付き生成定数Keffを18×10の10乗 Mとする。 EDTA溶液を60mL加えた時のCa2+イオンの濃度Ca2+を計算せよ。



Column



キレート滴定で緩衝液を入れすぎるとどうなるんでしょうか N Yahoo 知恵袋
pHが酸性であり、弱酸が水中で完全には解離していない ことがわかっています。滴定を開始したら、弱酸とその塩または酸性陰イオン の両方が存在する緩衝域(10~90%中和)が現れるのです。この緩衝域で塩基 を加えても、pHはわずかしか変化しません。 キレート滴定での金属指示薬と溶液のpH調整について お礼率 57% (84/147) EDTAで直接金属イオンを滴定する際、溶液のpHと指示薬を上手く組み合わせないと、副反応等で妨害イオンの影響を受けると聞きました。亜鉛イオン(Zn2)は、キレート滴定によって容易に定量できます。亜鉛のEDTA による滴定が できるpH 領域(pH45~10)は広くかつEDTA に対する安定度定数も大きく、鋭敏に変色する 指示薬も多




Woa1 Method For Culturing Koji Mold Through Use Of Basic Culturing And Use Of Induced Antimicrobial Composition Google Patents



年11月発行 カルシウム塩のキレート滴定について
示薬としてedta溶液で滴定し,edta溶液の正確な濃度を決定する。 4.キレート滴定によるca2+とmg2+の定量 試料水にph 10緩衝液を加え,edta溶液とebt指示薬を用いてキレート滴定を 行い,試料水に含まれるca2+とmg2+の合計量を定量する。成しないキレート剤、例えばアンモニア、アミン類に対しては効果の低い場合もある。 クエン酸1000mg/L と各種重金属をそれぞれmg/L 含む合成排水を、消石灰だけで pH 調整した場合と鉄塩+消石灰で処理した場合の比較例、及び、自動車工場における塗鉛イオン(Pb2)の定量法としては、一般にキレート滴定が広く活用されています。鉛イオンを直 接滴定できるpH 領域はpH35~10(安定度定数=17)となっています。しかしアルカリ性領 域で
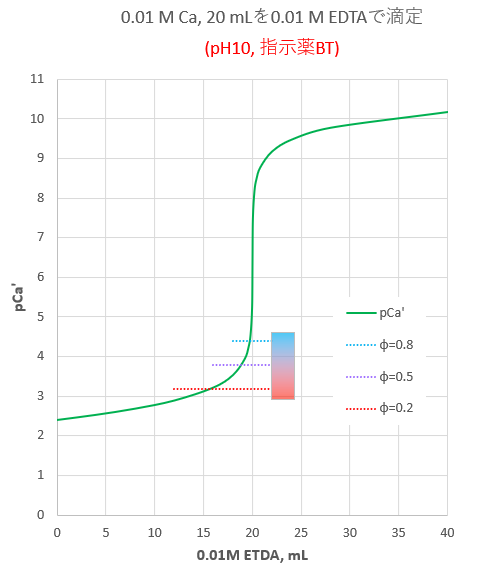



カルシウムのedta滴定 3 金属指示薬の選定 滴定曲線 溶解度などーエクセルを用いて




水道水と飲料水の硬度測定 硬度 キレート滴定 マスキング剤 Transblog
33.キレート滴定 キレート滴定では、金属イオンとキレート試薬(もっぱらedtaが使われる)が安定な錯体を作ることを利用する。 したがって、たとえば ebt の場合は滴定の終点として、完全に赤みの消えたところを取る。 キレート滴定では、ph の設定にPH 55 に調整し, 純水を加えて全量を約 35ml とした.さらに,光度計内部に光が入らないよ うに遮光して滴定を行なった. 実際には余り高い濃度の Cu(rr )溶液を使用することは滴定方法 として好ましくないため, クエン酸イオンの滴定には 5×103M Cuのph調整, めっき浴として再使用するための成分調 整からなり,これら一連の工程を繰り返し行った。なお 成分分析に関しては,ニッケルイオンはedta二ナト リウムによるキレート滴定分析,次亜リン




キレート滴定 Yakugaku Lab



2cのページ
法法法法という。EDTAは水にほとんど溶けないので、キレート滴定では水に溶けやすいEDTA ・2Naを用いる。 全硬度の測定は、試料水のpHを約10 に調整した後,BT指示薬を加えて、EDTA溶洷 で滴定して求める。キレート滴定 1.目的 キレート滴定法を用いて、未知試料中に含まれる金属イオン(Ca 2+、Mg 2+)の濃度 を調べ、さらに水の硬度についても計算して求める。また、実験を通してキレート滴定法 の原理や操作の仕方について学び、結果の考察をしてさらに理解を深める。PH値の測定に使用する水のpHを65~70と定めていたことを根拠に3時間を決定した. 滴定中に生じる液温変動は,実測値で2 ℃以内を許容しJIS Z 8703 試験場所の標準状態の温度1級を管理目標とし



2



水の硬度測定 キレート滴定
産総研地質調査総合センター / Geological Survey of Japan, AISTカルシウム硬度は水道水のpHを12以上に調整し、カルシウム用指示薬を用いてカルシウム 水道水のカルシウム硬度測定はキレート滴定(光度検出)で行います。 速やかにNN希釈粉末0.1gを加えて溶解し、0.01mol/L-EDTA溶液で滴定します。138 ∴pH =78 よって、 (1)の結果と合わせると、 Cd 2のキレート滴定の 至適 pH 範囲 は、 40 <pH <78 となる。 キレート滴定では、この至適 pH を保つために緩衝液が用いられる!



水の硬度測定 キレート滴定




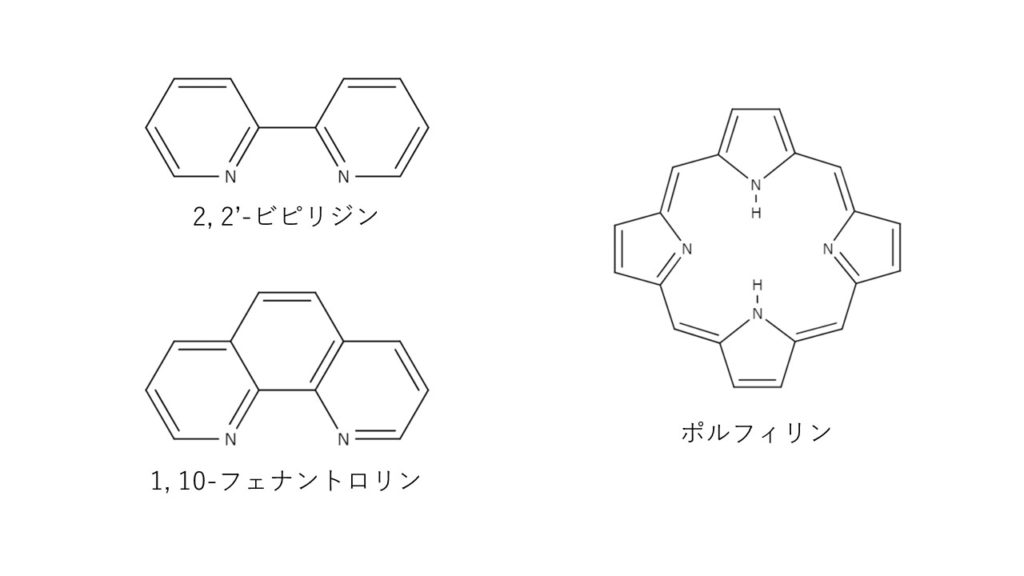
比色試薬 金属指示薬 Nn 同仁化学研究所
目的 鉛、ビスマス、スズを 1 2 1 で熔解(熔融)混合して可融(低融解点)合金の一つであるダルセ合金(融点 92℃)を調製し、その組成をキレート滴定で求める。金属試料を湿式分析するための前処理方法とキレート滴定について学習する。 原理(a1,(b1,(b2,(c1,(c2,(c3, 鉛(a1:(M=72その際重要なことは,pH 調整のために加え る試薬が後続の操作に支障をきたさないことである。 キレート滴定や吸光光度法においては,特定のpH 領 域での反応を利用するためpH 緩衝液を利用する場合が 多い。その際は,pH 緩衝液の成分が目的の反応に影響水の硬度測定 1 はじめに 硬度 1) とは,水に含まれるCa 2 とMg 2 の量を表す指標であり,この値に基づいて軟水や硬水 2) といった水の硬さが決められている。 軟水は口当たりがまろやか,硬水は苦みのような口当たりといわれている。近年,スーパーなどで多くの種類のミネラルウォーターを



比色試薬 金属指示薬 Xo 同仁化学研究所



2



2



キレート滴定の原理とエチレンジアミン四酢酸 Edta の性質についてわかりやすく解説 ジグザグ科学 Com
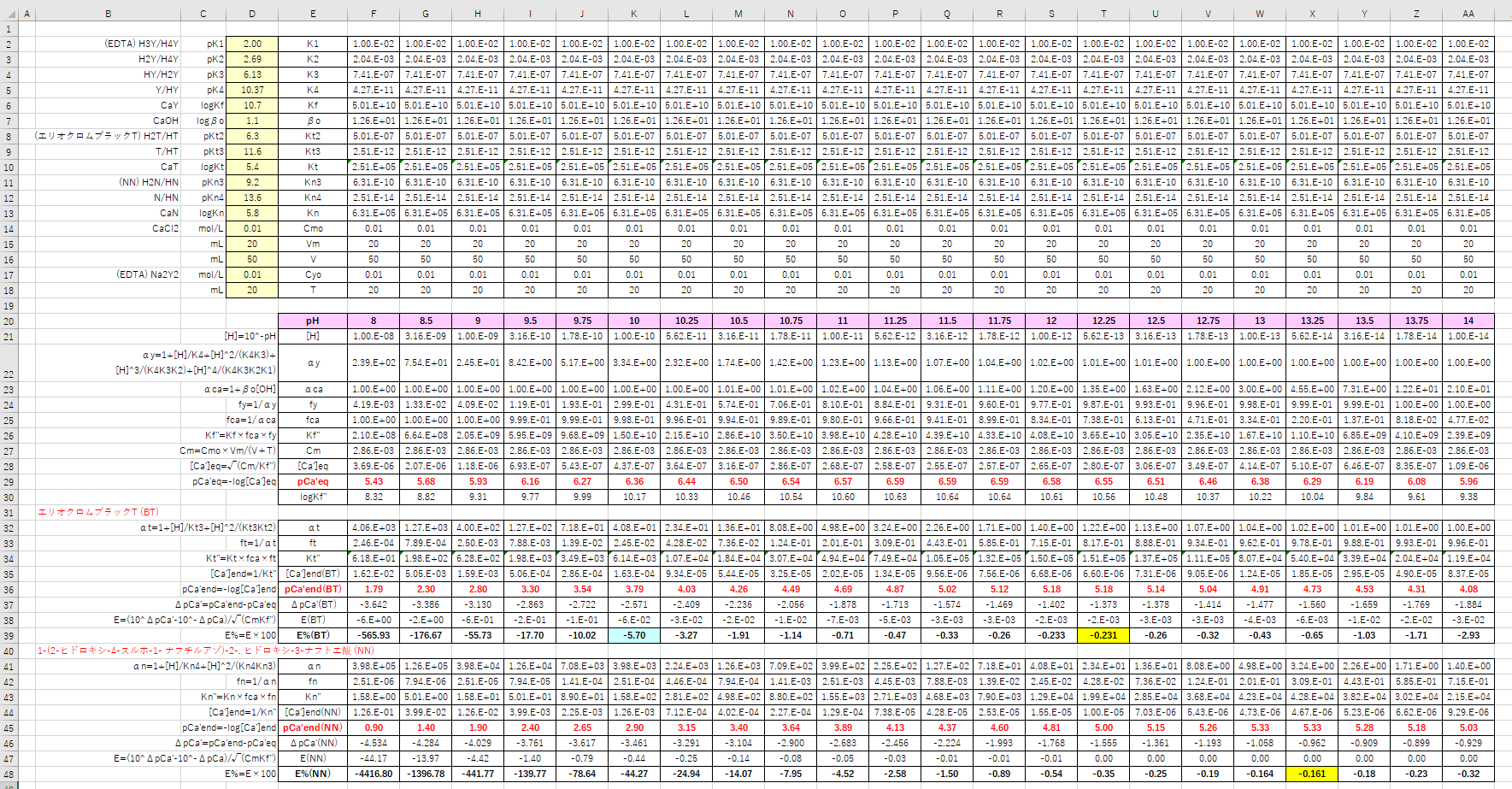



カルシウムのedta滴定 3 金属指示薬の選定 滴定曲線 溶解度などーエクセルを用いて



比色試薬 金属指示薬 Xo 同仁化学研究所




Ph 5 28 クエン酸ナトリウム緩衝液 10倍濃縮液 Ph 5 28 Sodium Citrate Buffer Solution 196 詳細情報 分析 試薬 富士フイルム和光純薬




04 0030号 液体dpd試薬 残留塩素濃度測定方法およびリン酸緩衝液 Astamuse
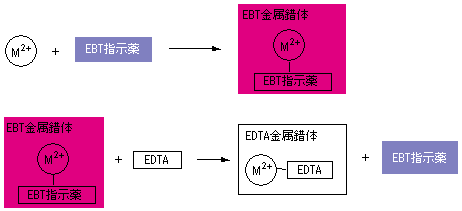



水の硬度測定
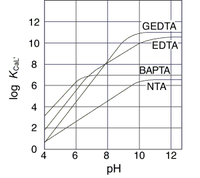



カルシウムキレート剤 脳科学辞典



キレートとは




トリエタノールアミン Wikipedia




1996 号 光学活性キレート鉄錯体およびその製法 Astamuse



キレート滴定の濃度計算問題についてです 解き方がわからないので 教えていただ Yahoo 知恵袋



2




17 号 キレート剤の定量方法 Astamuse




Woa1 Method For Culturing Koji Mold Through Use Of Basic Culturing And Use Of Induced Antimicrobial Composition Google Patents



Ph中和 基礎の基礎 Ph調整の方法 流体技術マガジン



2



キレート滴定の原理とエチレンジアミン四酢酸 Edta の性質についてわかりやすく解説 ジグザグ科学 Com




水道水と飲料水の硬度測定 硬度 キレート滴定 マスキング剤 Transblog



2



3回生実験のこと 容量分析の初歩ex




京都大学 化学実験操作法 操作法 2 4 キレート滴定 Mg イオンの定量 Youtube




12 号 硫酸アルミニウムの製造方法 Astamuse




比色試薬 金属指示薬 Xo 同仁化学研究所



キレート試薬 硬度滴定液 B 同仁化学研究所




中和滴定 Yakugaku Lab



Edta滴定の基礎 滴定曲線 溶解度などーエクセルを用いて



キレート滴定 Yakugaku Lab




標準緩衝液 中性りん酸塩ph標準液 Ph6 86 25 Buffer Solution Standard Phosphate Ph Standard Equimolal Solution Ph6 86 25 Degrees C 025 詳細情報 試薬 富士フイルム和光純薬



Kuchem Kyoto U Ac Jp




技術資料 Phガラス電極の基本と注意点 Ph計や滴定装置を使う人必見の入門者向け 技術資料 事例集 メトロームジャパン イプロスものづくり



2




02 2353号 重炭酸固形透析用剤 Astamuse




試薬とは コトバンク



コロイド滴定 容量分析 分析 試薬 富士フイルム和光純薬



3
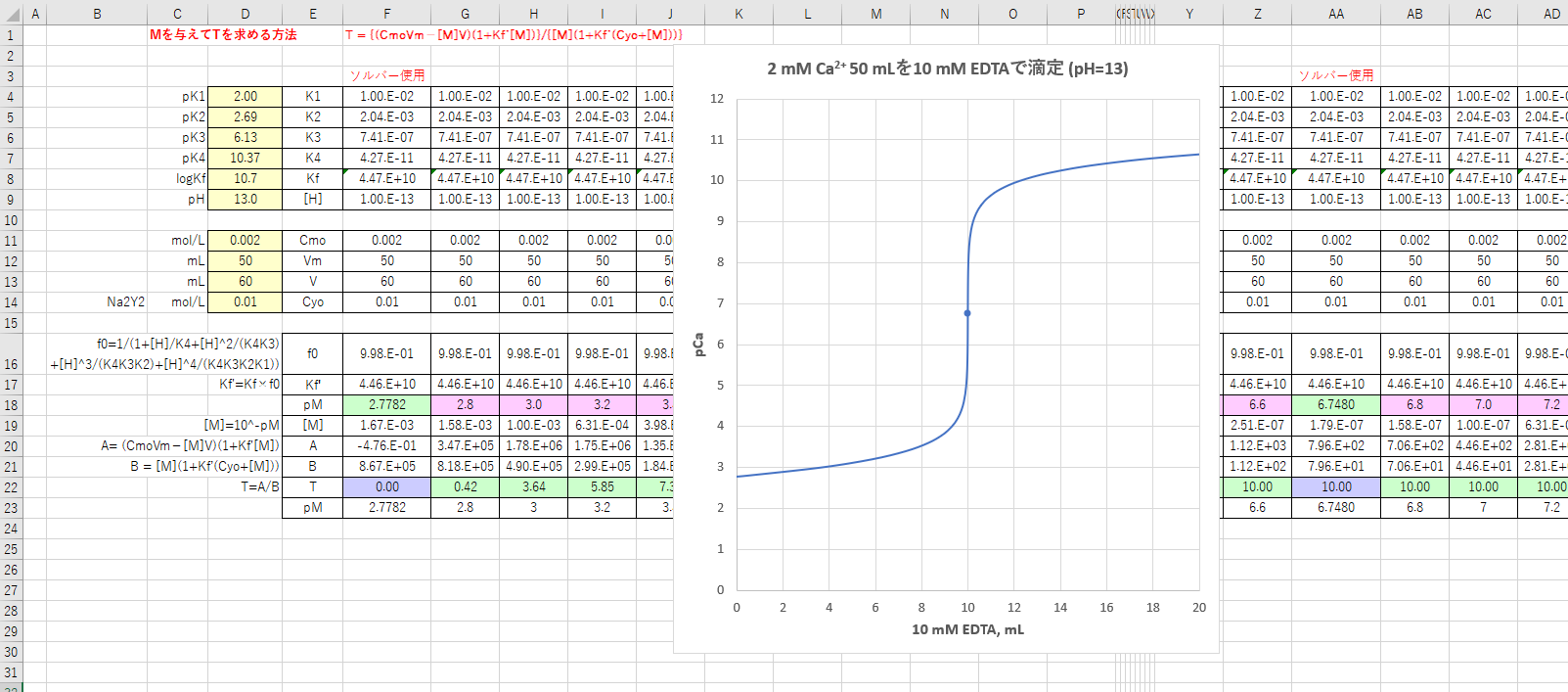



カルシウムのedta滴定 1 滴定曲線 溶解度などーエクセルを用いて




灰中の酸化カルシウム




水道水と飲料水の硬度測定 硬度 キレート滴定 マスキング剤 Transblog
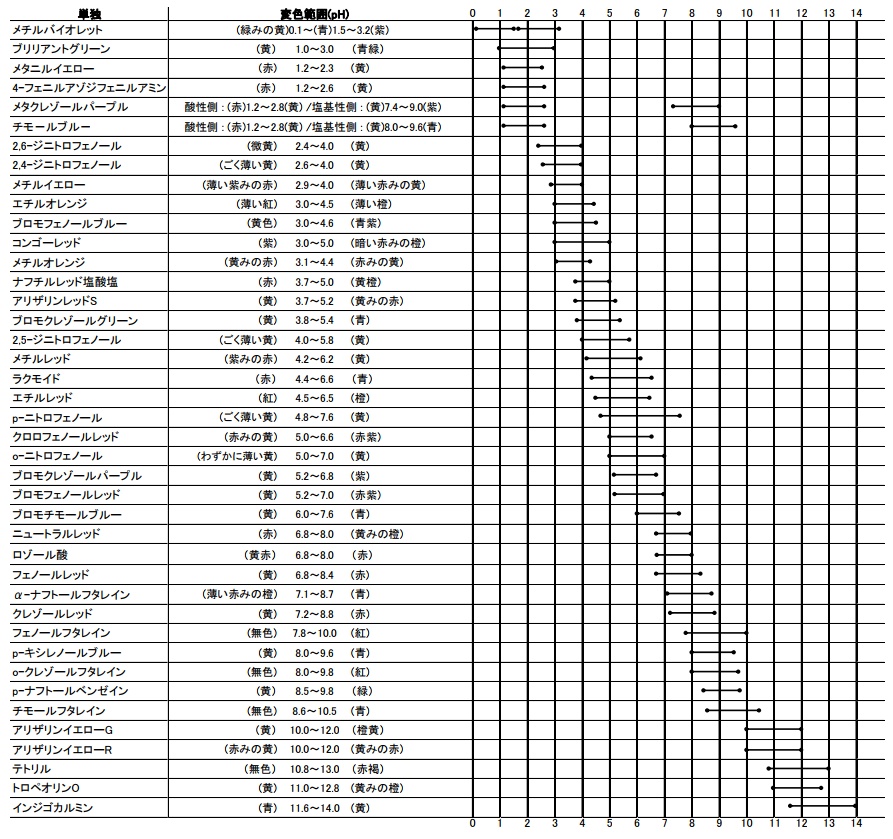



Ph指示薬変色範囲 お問合せ 試薬 富士フイルム和光純薬




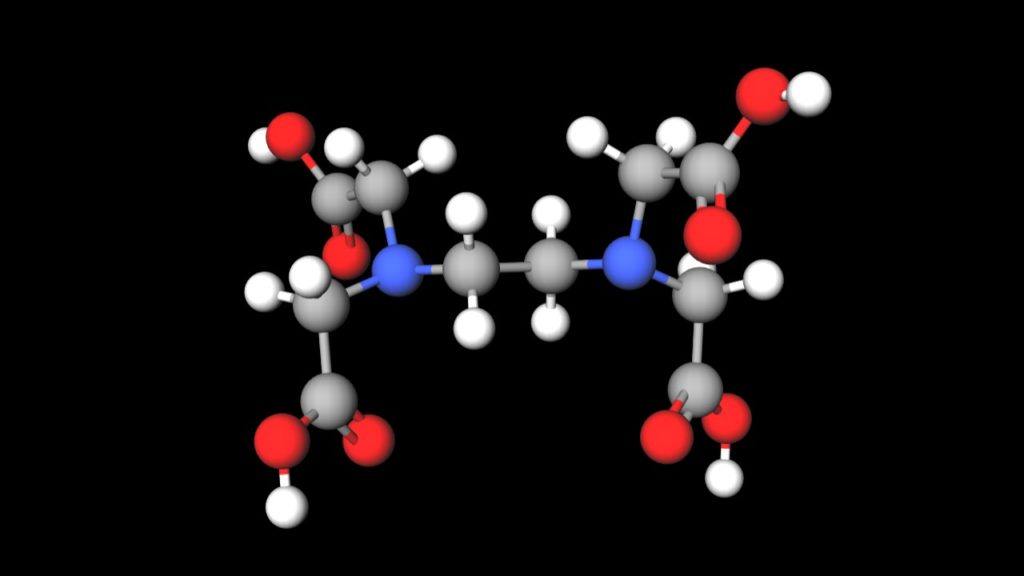
エチレンジアミン四酢酸 Wikipedia




Jcss Ph標準液 分析 製品情報 試薬 富士フイルム和光純薬
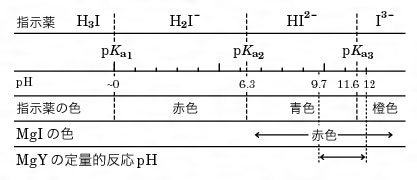



キレート滴定とは コトバンク



水の硬度測定 キレート滴定




比色試薬 金属指示薬 Pan 同仁化学研究所



容量分析の実験 参考文献 基礎分析化学 新 物質科学ライブラリ 1 容量分析の基礎 原子吸光やicp 蛍光x線などの機器分析では 有効数字が2 3桁程度であるのに対し 湿式分析 容量分析 や重量分析では4桁が可能である 容量



水の硬度測定 キレート滴定




ヤフオク New薬品分析化学 第2版 化学的分析法の基礎と薬




Woa1 エッチング剤 エッチング方法及びエッチング剤調製液 Google Patents



水の硬度測定



キレート滴定の原理とエチレンジアミン四酢酸 Edta の性質についてわかりやすく解説 ジグザグ科学 Com
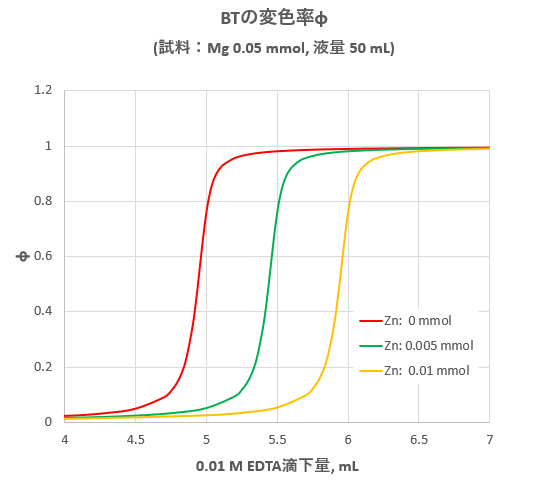



Edta滴定における妨害金属イオンのマスキング 滴定曲線 溶解度などーエクセルを用いて
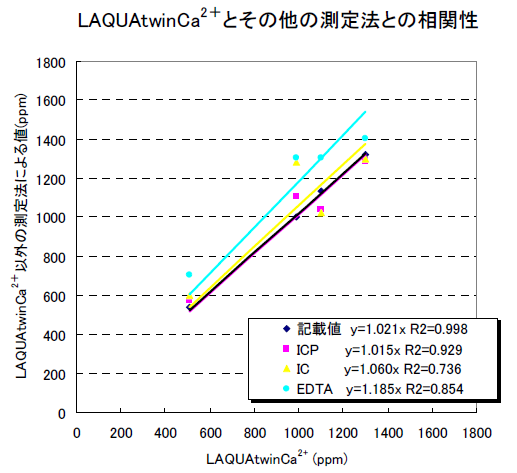



Laquatwinによる牛乳及び乳飲料中のカルシウム測定 Horiba



2




自動滴定装置 Gt 310 自動滴定装置 滴定計 日東精工アナリテック 旧社名 三菱ケミカルアナリテック



2



容量分析の周辺
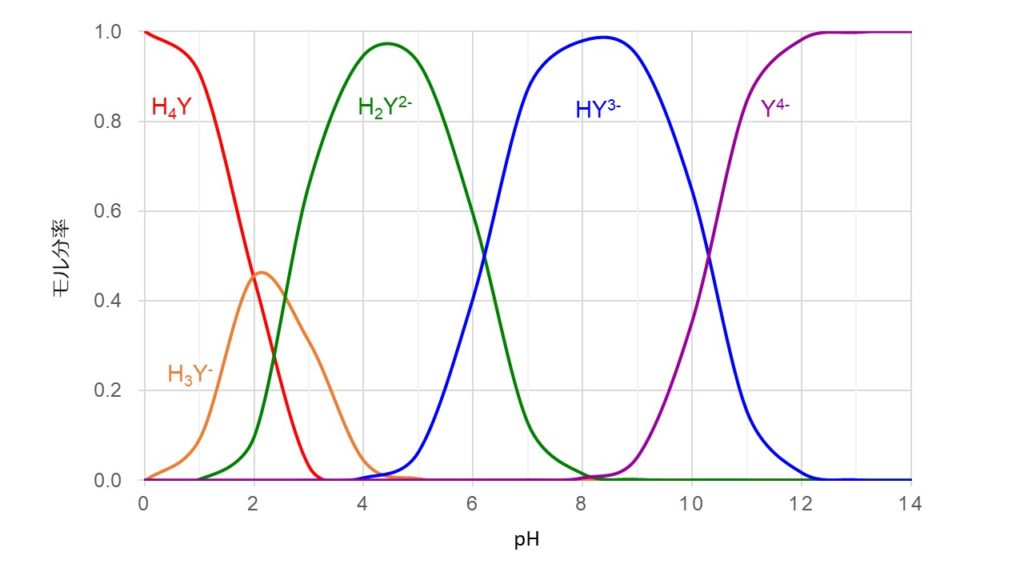



キレート滴定の原理とエチレンジアミン四酢酸 Edta の性質についてわかりやすく解説 ジグザグ科学 Com
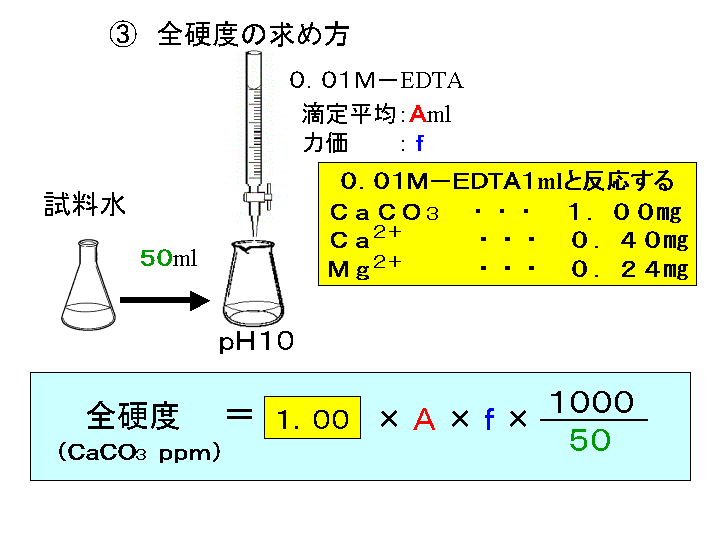



水の硬度測定 キレート滴定




フタル酸塩ph標準液 Phthalate Ph Standard Solution 166 168 詳細情報 分析 試薬 富士フイルム和光純薬



キレート わかりやすく




17 号 キレート剤の定量方法 Astamuse



水の分析



2



50 金属指示薬 金属指示薬 一覧 Roberthebbjp




比色試薬 金属指示薬 Bt 同仁化学研究所



カルシウムキレート剤 脳科学辞典



容量分析の実験 参考文献 基礎分析化学 新 物質科学ライブラリ 1 容量分析の基礎 原子吸光やicp 蛍光x線などの機器分析では 有効数字が2 3桁程度であるのに対し 湿式分析 容量分析 や重量分析では4桁が可能である 容量



容量分析の実験 参考文献 基礎分析化学 新 物質科学ライブラリ 1 容量分析の基礎 原子吸光やicp 蛍光x線などの機器分析では 有効数字が2 3桁程度であるのに対し 湿式分析 容量分析 や重量分析では4桁が可能である 容量




キレート滴定の原理とエチレンジアミン四酢酸 Edta の性質についてわかりやすく解説 ジグザグ科学 Com
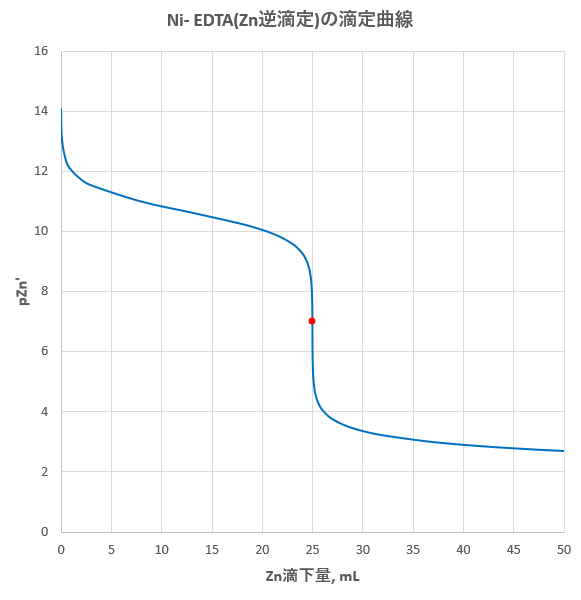



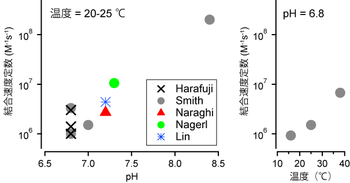
Edta 滴定曲線 溶解度などーエクセルを用いて



年11月発行 カルシウム塩のキレート滴定について
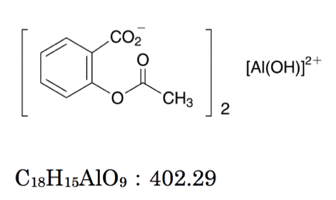



キレート滴定 Yakugaku Lab
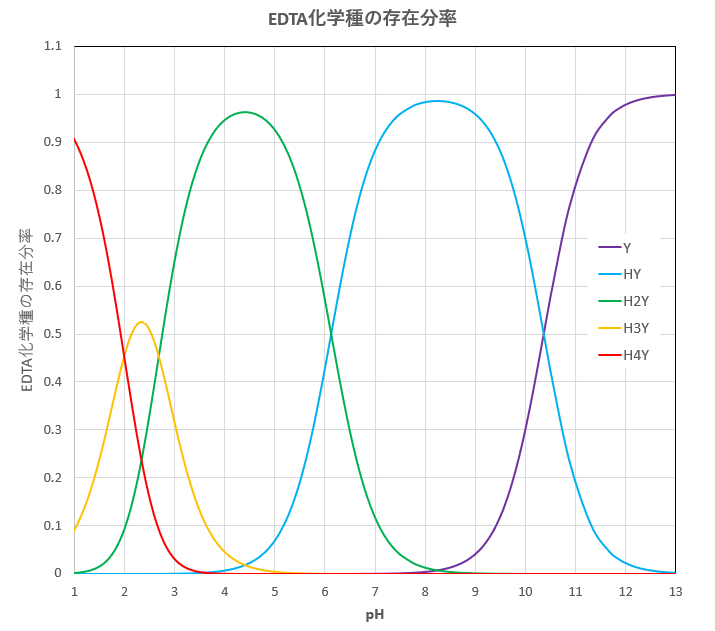



Edta滴定の基礎 滴定曲線 溶解度などーエクセルを用いて



容量分析の実験 参考文献 基礎分析化学 新 物質科学ライブラリ 1 容量分析の基礎 原子吸光やicp 蛍光x線などの機器分析では 有効数字が2 3桁程度であるのに対し 湿式分析 容量分析 や重量分析では4桁が可能である 容量



1



ひたすら受験問題を解説していくブログ東京大学12年前期化学第2問ii




03 1646号 キレート系重金属処理剤の必要添加量の決定方法及び薬注制御方法 Astamuse



2cのページ



質問箱
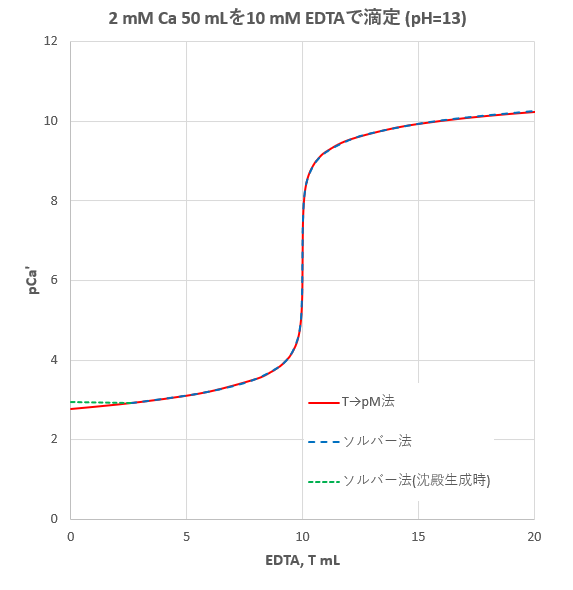



カルシウムのedta滴定 2 滴定曲線 溶解度などーエクセルを用いて




17 号 キレート剤の定量方法 Astamuse




0 1mol L トリス塩酸緩衝液 Ph 7 3 0 1mol L Tris Hcl Buffer Solution Ph 7 3 1 詳細情報 試薬 富士フイルム和光純薬



ひたすら受験問題を解説していくブログ東京大学12年前期化学第2問ii



2
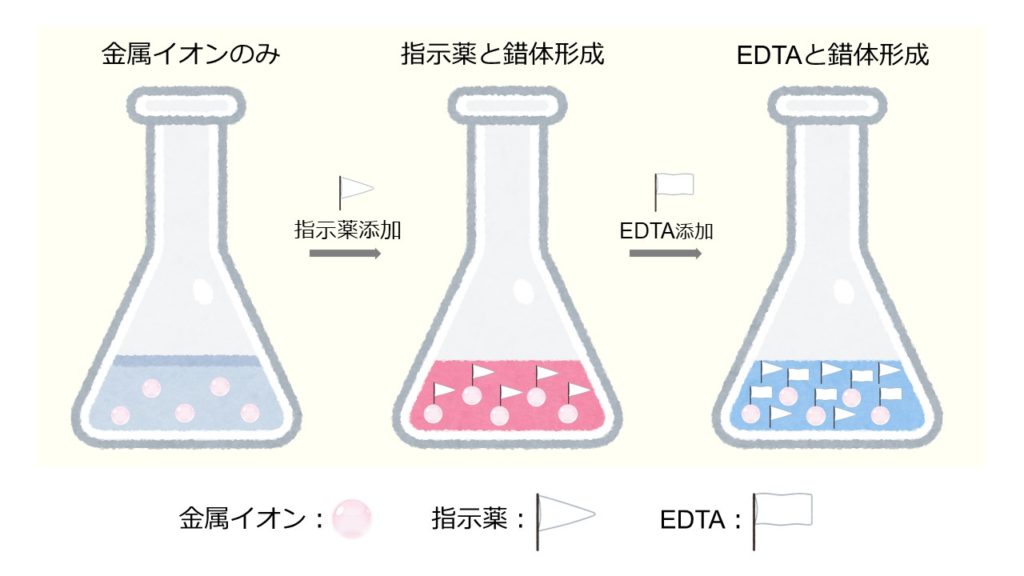



キレート滴定の原理とエチレンジアミン四酢酸 Edta の性質についてわかりやすく解説 ジグザグ科学 Com



0 件のコメント:
コメントを投稿